研究成果
ウェルシュ菌毒素により引き起こされる密着結合破壊メカニズムの解明
タンパク質機能・構造研究チームの篠田雄大研究員、白水美香子チームリーダー(副センター長)、染谷友美上級研究員らと横山構造生物学研究室の横山茂之上席研究員らとの共同研究グループ※は、ヒトクローディン-4とウェルシュ菌毒素との複合体のX線結晶構造解析により、ウェルシュ菌毒素により引き起こされる密着結合破壊メカニズムの詳細な解明に成功しました。
密着結合の帯状構造物(密着結合ストランド)を構成する膜タンパク質クローディン-4は、腸管粘膜に局在して、異物の侵入を防ぐバリアとして機能しています。また、クローディン-4は上皮性腫瘍細胞において発現が亢進しており、新しい癌治療標的分子候補として期待されています。食中毒の原因菌であるウェルシュ菌が産生する毒素Clostridium perfringens enterotoxin(CPE)は、ヒトクローディン-4に対して高い親和性を示すC末端側ドメイン(C-CPE)を介して腸管粘膜のクローディン-4に結合し、密着結合を破壊することで下痢を引き起こすことが知られています。このような性質を持つC-CPEは、クローディン-4を標的とした薬剤デリバリー技術や腫瘍マーカーとしての利用など、全く新しい診断・治療手法への利用が期待されており、すでに多くの研究が進められています。一方で、C-CPEはクローディン-4以外のクローディンファミリー分子に対してもわずかに結合性を有している為、正確に標的のクローディンのみを制御することが臨床応用への課題の一つとなっています。そこで、共同研究グループでは、ヒトクローディン-4•C-CPE複合体の X線結晶構造解析を行い、標的クローディンへの特異性を高める工夫に必要不可欠な、ヒトクローディン-4/C-CPE間相互作用のアミノ酸レベルでの詳細な解明に挑みました。
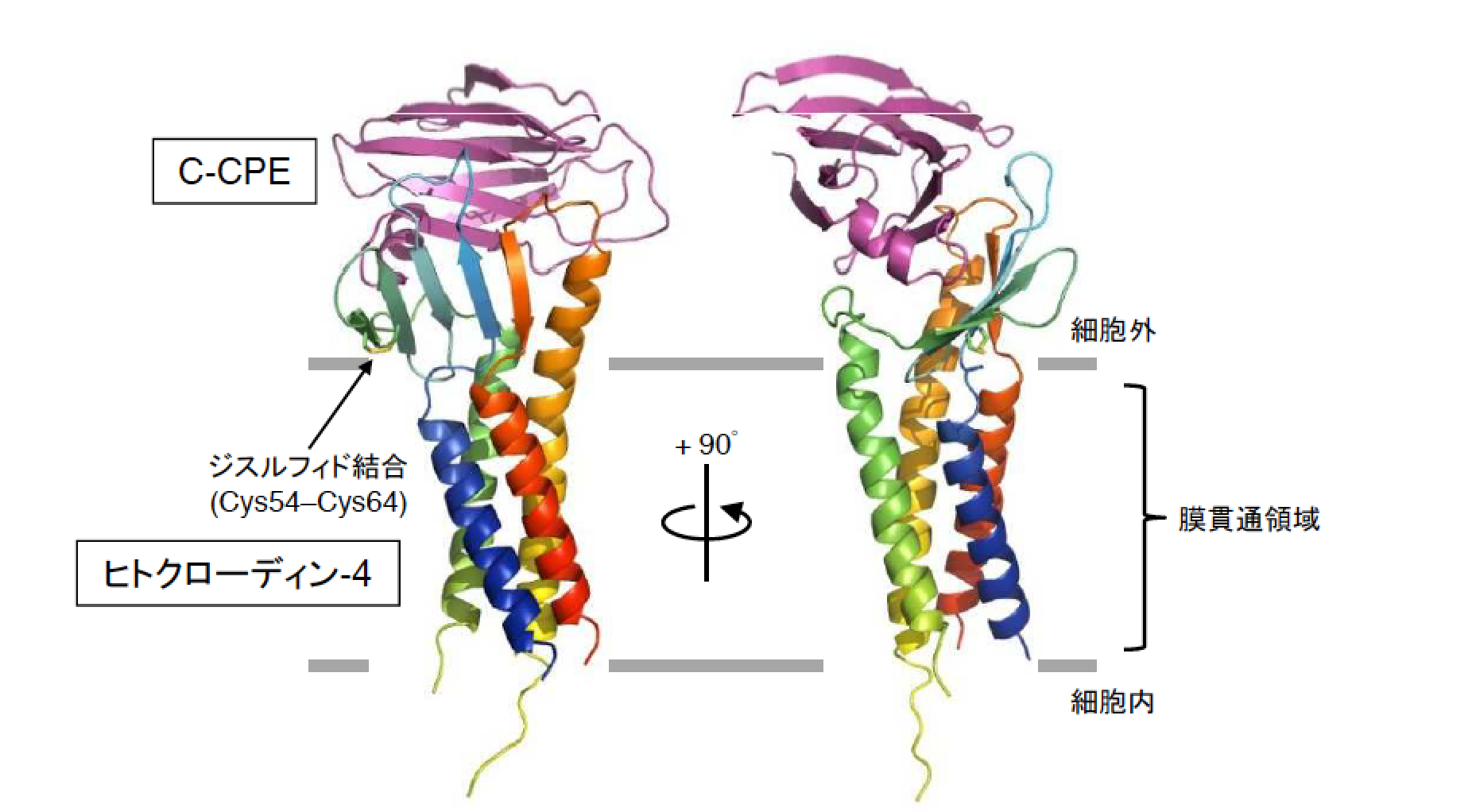
共同研究グループは、初めに、大腸菌無細胞タンパク質合成技術を用いた新しい膜タンパク質調製手法を開発し(Shinoda et al, Sci. Rep. 2016, 6:30442)、生細胞発現システムでの大量調製が不向きなヒトクローディン-4の精製技術を確立しました。このヒトクローディン-4をC-CPEとの複合体として精製し、蒸気拡散法により結晶を調製、大型放射光施設SPring-8でのX線回折実験を経て、3.5オングストローム分解能での立体構造決定に成功しました(図1)。無細胞タンパク質合成システムを利用した哺乳類膜タンパク質の立体構造決定は本研究が世界初となります。
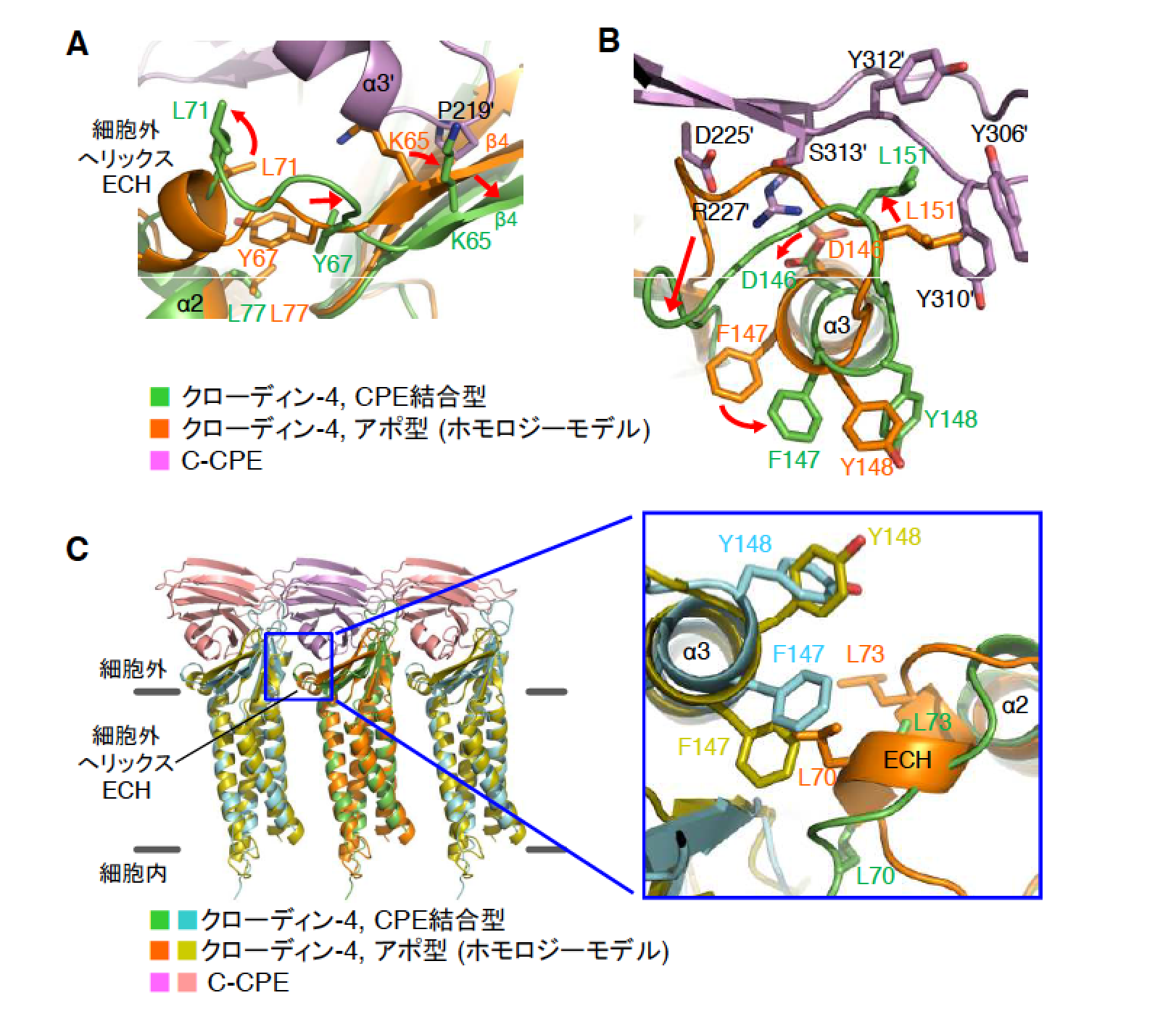
決定された立体構造を基に詳細な解析を行い、ヒトクローディン-4の35番目のアミノ酸であるフェニルアラニンとC-CPEの315番目のロイシン間の疎水性相互作用を中心とした12箇所の相互作用が、ヒトクローディン-4の細胞外領域とC-CPEとの間に存在することを明らかにしました。また、2015年に斉藤らが発表したマウスクローディン-19•C-CPE変異体複合体構造との比較から、両者の結合様式の違いも明らかにしました。さらに、2014年に鈴木らが発表したマウスクローディン-15単体の構造を基にヒトクローディン-4単体のホモロジーモデルを作成し、本研究で決定された立体構造と重ねて比較したところ、C-CPE結合により、密着結合ストランド形成に関わるヒトクローディン-4の細胞外領域2箇所に構造変化が生じていることを発見しました(図2A-C)。C-CPEにより引き起こされる密着結合破壊メカニズムに関するアミノ酸レベルでの詳細な解明は世界初となります。
本研究により得られたクローディン-4とC-CPEとの相互作用、およびC-CPE結合により引き起こされるクローディン-4との構造変化に関する詳細な立体構造情報は、クローディン-4への特異性を高めたC-CPE変異体の作成が可能となり、C-CPEの腫瘍治療などへの臨床応用を大きく前進させることが出来ます。さらに、他のクローディンファミリー分子、特に血液脳関門において分子サイズ選択性を担うクローディン-5に対して特異性を示す新しいC-CPE変異体を作成することも可能となることから、将来的には、C-CPE変異体を用いて、分子サイズふるいを一過的に開放させ、中枢神経疾患の治療で問題となる中枢神経系への薬剤送達を容易にする、これまでにない治療方法の開発が期待出来ます。
(以下共同研究グループ)※
理化学研究所
ライフサイエンス技術基盤研究センター 構造・合成生物学部門
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子 (しろうず みかこ)(副センター長)
上級研究員 染谷 友美 (そめや ともみ)
研究員 篠田 雄大 (しのだ たけひろ)
研究員 大沢 登 (おおさわ のぼる)
技師 新屋(野村) 直子 (しんや のむら なおこ)
技師 伊東 夏織 (いとう かおり)
横山構造生物学研究室
上席研究員 横山 茂之 (よこやま しげゆき)
研究員 寺田 貴帆 (てらだ たかほ)
放射光科学総合研究センター
利用システム開発研究部門生命系放射光利用システム開発ユニット
ユニットリーダー 山本 雅貴 (やまもと まさき)(部門長)
専任技師 平田 邦生 (ひらた くにお)
専任技師 河野 能顕 (かわの よしあき)
=関連プレスリリース=
細胞を使わない膜タンパク質の合成技術(2016年8月1日発表)