一般の方へ
薬はどのように作られるのか?
こんにちは。私はライフサイエンス技術基盤研究センターの梅原と申します。本日は「薬はどのようにつくられるのか?」という演題でお話をさせて頂きます。実は私自身、ここ数年脱毛症を患っておりまして、薬のお世話になっています。本日お越し頂いた皆様の中にも、ご自身や身近な方々に持病があって「病気を治したい」という切実な思いをお持ちの方がおられるかと思います。本日は、薬がどのようにつくられるのか、その基礎研究の一端についてお話しさせて頂きます。
薬は一つ一つ異なる「顔」を持つ
皆様も、これまでに少なくともひとつは医薬品を服用されたことがあるかと思います。例えば風邪をひいた時に飲む解熱剤や鎮痛剤、それからアルツハイマー病やがんなどを治療する薬もあります。医薬品のパッケージだけではよくわかりませんが、こうした薬はそれぞれ異なる「かたち」をもっています。
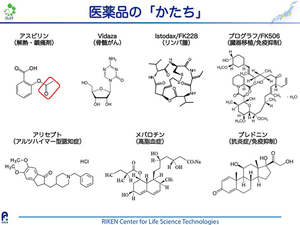 右の図は、いくつかの医薬品の主要成分とその構造式を示しています。ひとくちに薬と言っても様々な「かたち」があることがわかります。例えばバファリン®などの解熱剤として知られるアスピリンの主要成分は「アセチルサリチル酸」で、サリチル酸という柳の樹皮に含まれる成分に基づいて作られています。サリチル酸は古くから鎮痛作用を持つことが知られていて、たとえば爪楊枝も柳の枝を噛むと歯痛が抑えられるため、使われていたそうです。ただ、サリチル酸のままでは副作用が強かったため、約120年前にドイツの研究者らがサリチル酸を図の赤枠のようにアセチル化修飾する有機反応を行い、副作用が少ないアスピリンが開発されました。
右の図は、いくつかの医薬品の主要成分とその構造式を示しています。ひとくちに薬と言っても様々な「かたち」があることがわかります。例えばバファリン®などの解熱剤として知られるアスピリンの主要成分は「アセチルサリチル酸」で、サリチル酸という柳の樹皮に含まれる成分に基づいて作られています。サリチル酸は古くから鎮痛作用を持つことが知られていて、たとえば爪楊枝も柳の枝を噛むと歯痛が抑えられるため、使われていたそうです。ただ、サリチル酸のままでは副作用が強かったため、約120年前にドイツの研究者らがサリチル酸を図の赤枠のようにアセチル化修飾する有機反応を行い、副作用が少ないアスピリンが開発されました。
このように西洋医学では、有機合成反応によって作られた比較的小型の化合物や、天然物などから抽出された複雑な構造をもつ化合物が主要成分として医薬品に使われています。このような構造を示す構造式はひとつひとつの化合物で異なるため、医薬品の「顔」とも言えます。薬づくりを行う上で最も重要な仕事の一つは、新しい「顔」すなわち新しい構造式を持つ分子(生理活性物質)を開発することです。
それでは、これまでに開発された医薬品では、どれだけの病気が治せるのでしょう。患者さんからみた疾患ごとの「治療満足度」と疾患に対する「医薬品の貢献度」の関連を調査したヒューマンサイエンス振興財団の調査報告書によると、基本的には「医薬品の貢献度」が高いほど患者さんの「治療満足度」も高いことがわかります。しかし、「医薬品の貢献度」と「治療満足度」のいずれも高い疾患というのは非常に数少なく、多くの疾患においては患者さんを満足させられるような医薬品が開発できていないのです。したがって、新薬開発や創薬に必要な新規技術の開発がまだまだ求められていると考えられます。
ゲノムからつくられる2万種類のタンパク質
身体の外から取り入れた薬は私たちの身体にどのように効くのでしょう? 新薬開発の話を進める前に、まずは私たちの身体の成り立ちについてお話ししましょう。
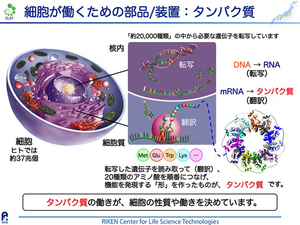
私たち生物は細胞を基本単位として成り立っており、ヒトの場合は約37兆個の細胞で構成されていると言われています。一つの細胞は細胞膜で区画されていて、ヒトのような真核生物ではその細胞内に核膜で区画された核があります。私たちの大切な遺伝情報は、この核のなかにゲノムDNAという形で保存されています。多細胞からなる個体の一つの細胞を建物の1室と捉えると、核はその室内の書斎、ゲノムDNAはその書斎中の本全体と捉えるとよいでしょう。ヒトの場合は約2万種類の遺伝子がゲノムDNA中にありますので、約2万冊の本(設計図)からなる書斎が細胞核のイメージです。一部の例外を除いて、基本的に全身の細胞は同じ情報の本(設計図)を一式持っています。どの本(設計図)を読むか(コピーするか)は細胞ごとに異なります。そして、核でコピーされた設計図は核外の細胞質に運ばれて、設計図の情報に基づいてタンパク質が一つ一つ正確に作られます。
タンパク質がつくられるためには、まず約2万種類の遺伝子のうちその細胞で必要な遺伝子が選択的にコピーされます。これを「転写」といい、転写産物は編集されてmRNA(メッセンジャーRNA)になります。例えば眼の細胞では水晶体を作るクリスタリンというタンパク質が必要ですので、その設計図であるクリスタリン遺伝子が大量に転写されます。転写されたmRNAには、4種類の塩基が1塩基ずつ文字のように順番に並んでいますが、これが遺伝子情報の実体です。mRNAの遺伝情報は、細胞質中のリボソームと呼ばれるタンパク質合成工場で解読されます。mRNAの塩基の文字列は、端から3文字ずつ読み取って解読されます。3塩基の組み合わせパターンによって、タンパク質を構成する20種類のアミノ酸のうち1種が指定され、設計図が順番に指定しているアミノ酸を順番に一つずつ連結することでタンパク質が形づくられます。このようにして合成されるタンパク質同士がうまく連携して働くことで、細胞の性質や働きが決まります。
タンパク質の「かたち」
タンパク質の働きを決める上で最も重要な点はその「立体構造」です。DNAの場合、どのような遺伝情報を持っていても大枠の立体構造は変わりませんが、DNAの遺伝情報に基づいて作られたタンパク質の場合、その構造には様々なバリエーションがあります。DNAは、保持している情報(塩基配列情報)が最も重要ですので、DNAのどの部分でも同じように情報が読み出されるように、どの部分も基本的には類似した構造を持つのが合理的です。一方タンパク質は、細胞を形づくったり、特定の機能をもたせたりする部品として細胞種・機能ごとにふさわしい多様な「かたち」をもつ必要があります。この図は私たちのグループが構造解明したタンパク質複合体の例ですが、個々のタンパク質の機能を発揮するためにその形が非常にバラエティーに富んでいることがご確認頂けるかと思います。
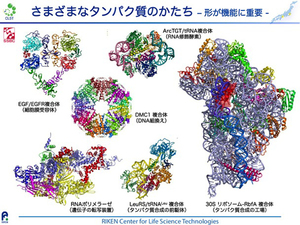 私が所属する構造・合成生物学部門では、前身の生命分子システム基盤研究領域(SSBC)やゲノム科学総合研究センター(GSC)の頃から継続してタンパク質の立体構造解析研究とその解析基盤の構築を進めております。タンパク質の詳細な立体構造を高分解能で解析する方法は主に2種類あります。一つは、強力な磁場によるタンパク質分子の原子核の共鳴現象を用いて原子同士の立体的なつながりを解析する核磁気共鳴(NMR)法です。もう一つはタンパク質分子を規則的に結晶させてその結晶にX線を当てて回折像を解析するX線結晶構造解析法です。前者はここ理研横浜キャンパス(および併設の横浜市立大学、大阪大学蛋白質研究所)が国内における最大拠点です。後者は、兵庫県の播磨にある大型放射光施設SPring-8(理研播磨キャンパス)と茨城県つくば市にある高エネルギー加速器研究機構が放射光施設の2大拠点です。各研究室やこれらの拠点施設を利用した研究により、複雑なタンパク質の構造解析が日夜行われています。
私が所属する構造・合成生物学部門では、前身の生命分子システム基盤研究領域(SSBC)やゲノム科学総合研究センター(GSC)の頃から継続してタンパク質の立体構造解析研究とその解析基盤の構築を進めております。タンパク質の詳細な立体構造を高分解能で解析する方法は主に2種類あります。一つは、強力な磁場によるタンパク質分子の原子核の共鳴現象を用いて原子同士の立体的なつながりを解析する核磁気共鳴(NMR)法です。もう一つはタンパク質分子を規則的に結晶させてその結晶にX線を当てて回折像を解析するX線結晶構造解析法です。前者はここ理研横浜キャンパス(および併設の横浜市立大学、大阪大学蛋白質研究所)が国内における最大拠点です。後者は、兵庫県の播磨にある大型放射光施設SPring-8(理研播磨キャンパス)と茨城県つくば市にある高エネルギー加速器研究機構が放射光施設の2大拠点です。各研究室やこれらの拠点施設を利用した研究により、複雑なタンパク質の構造解析が日夜行われています。
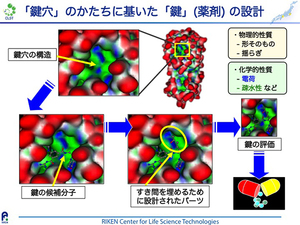
鍵穴に合う鍵(化合物)を設計する
それではいよいよ、薬を作る行程をみていきます。医薬品候補となる化合物の開発方法は大きく分けて2種類あります。一つは、多くの製薬会社で昔から行われている方法で、自社が持っている膨大な種類の化合物(化合物ライブラリー)を鍵穴となる疾患関連タンパク質や疾患モデルとなる細胞にふりかけて、ヒット化合物を探索する方法です。アプローチとしては「宝探し」に近く、数多くある化合物を一度に探索できるという点では優れていますが、各社が保有するライブラリーの質や資本力に左右されるという欠点もあります。もう一つの代表的な例は、鍵穴となる疾患関連タンパク質の立体構造を解明し、その構造から機能を担う部位を理解して、その機能を阻害する化合物を設計するというアプローチです。実際、創薬にはどちらのアプローチも必要で、両者を併用しているケースがほとんどかと思いますが、後者のように構造を見ながら進めるアプローチには、開発中の分子がなぜうまく効いたり、効かなかったりするのか、少なくともその一端を理解できるという利点があります。また、よりよい化合物を作る次の一手を合理的に考えることもできます。まさに「百聞は一見に如かず」のアプローチといえます。
この図は、ある分解酵素タンパク質の例ですが、黄色い四角に囲まれた部分に特徴的なくぼみを持っています(右図)。これが鍵穴の構造です。この部分に別のタンパク質が結合して酵素活性が発揮されるので、その結合を阻害するには、同じように酵素にうまくはまる化合物を見つける必要があります。そこで、まずは既存の分子でくぼみに結合できるものがあるかどうかを、計算機を用いたシミュレーションで探します。そのようにして見いだされた化合物とタンパク質との複合体構造を解析すると、化合物は確かにくぼみに結合していたものの、鍵穴をぴったりとは塞いでおらず、すき間があることがわかりました。そこで、このすき間を埋めるようなパーツを設計して元の化合物に付加します。タンパク質は機械の部品のようにカチッと硬いものではなく、時にはゆらぎをもった運動性の高い部分もあるため、そうした物理的な性質を考慮した設計が必要です。
また、タンパク質の「かたち」というのは単に物理的な形状だけではなく、その化学的な性質も考慮しなければなりません。例えば、右図のタンパク質表面の青い部分は正電荷を帯びています。形がいくらぴったりはまっても正電荷をもつ化合物はこの位置では反発しますので、負電荷を帯びやすい原子がくるように設計したりします。このようにして最初に探り当てた候補分子をさらに高い強度で特異的に結合できるよう、構造改変の設計をします。それらの候補化合物群を合成した後に、目的の阻害活性を持つかどうかを実際に測定して、よりよい化合物を選別します。その後、もう一度その化合物がどのように鍵穴に結合しているのかを構造的に調べるわけです。実際に私たちのグループが阻害剤開発を行った例では、このサイクルを3回繰り返すことで、最初に選定された化合物より100倍以上阻害活性が強い低分子化合物を開発することができました。構造に基づいて分子開発をすると、化合物の構造式に無駄な部分がほとんどない低分子を取得できる点が大きな利点です。このメリットは、細胞膜を透過する医薬品候補分子を効率的に開発する上で極めて重要です。
「試薬」が「医薬」になるまでには
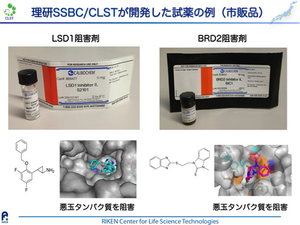 このような化合物の開発は、多種多様なタンパク質に対して行われています。ある特定のタンパク質をうまく制御する化合物が開発されると、試薬として市販されることがあります。右の図は私たちが開発した試薬の例です。化合物が試薬として市販されると世界中のグループが利用できますので、そのタンパク質の機能や、その機能の制御がもたらす効果などについて、新たな発見につながります。例えばこの図の左の試薬はヒストン脱メチル化酵素と呼ばれるタンパク質の働きを阻害する化合物として開発したのですが、のちの研究によって、この酵素を阻害すると脂肪細胞における脂肪蓄積を抑える効果があることがわかりました。また海外でも複数の研究グループがこの試薬を用いて研究をおこなった結果、特定のがん幹細胞の増殖を抑えるなどの新知見がもたらされています。このように、タンパク質の機能を制御する試薬は、生命現象を理解するための道具として用いられることで、新たな発見につながるという研究の循環が起こるのです。
このような化合物の開発は、多種多様なタンパク質に対して行われています。ある特定のタンパク質をうまく制御する化合物が開発されると、試薬として市販されることがあります。右の図は私たちが開発した試薬の例です。化合物が試薬として市販されると世界中のグループが利用できますので、そのタンパク質の機能や、その機能の制御がもたらす効果などについて、新たな発見につながります。例えばこの図の左の試薬はヒストン脱メチル化酵素と呼ばれるタンパク質の働きを阻害する化合物として開発したのですが、のちの研究によって、この酵素を阻害すると脂肪細胞における脂肪蓄積を抑える効果があることがわかりました。また海外でも複数の研究グループがこの試薬を用いて研究をおこなった結果、特定のがん幹細胞の増殖を抑えるなどの新知見がもたらされています。このように、タンパク質の機能を制御する試薬は、生命現象を理解するための道具として用いられることで、新たな発見につながるという研究の循環が起こるのです。
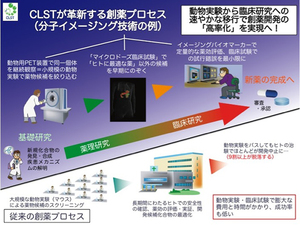 しかしながら、このようにして開発された「試薬」がヒトに投与される「医薬」になるまでには、クリアしなければならない関門がいくつもあります。例えば、医薬品は単に細胞膜透過性を持つだけでは不十分で、個体において適切な体内動態を示したり、時間経過に従って良好に代謝されたりする必要があります。体内動態とは、身体に取り込まれた分子が体内を移動して分布する様子のことで、例えば肝臓に溜まりすぎて肝毒性をもたらすとか、代謝が速すぎて目的の疾患細胞に到達する前に大部分が分解されてしまうといった問題点がないかどうかを調べる必要があります。これを可能にするのが、分子イメージングという技術です。代表的な分子イメージングである陽電子放出断層画像法(PET)イメージングにおいては、医薬品候補として開発した分子を安定同位体で標識することで、サルなどの高等動物やヒトでの体内動態を調べることが可能です。この技術は、私たちライフサイエンス技術基盤研究センターの神戸キャンパスにおいて研究技術開発が進められています。
しかしながら、このようにして開発された「試薬」がヒトに投与される「医薬」になるまでには、クリアしなければならない関門がいくつもあります。例えば、医薬品は単に細胞膜透過性を持つだけでは不十分で、個体において適切な体内動態を示したり、時間経過に従って良好に代謝されたりする必要があります。体内動態とは、身体に取り込まれた分子が体内を移動して分布する様子のことで、例えば肝臓に溜まりすぎて肝毒性をもたらすとか、代謝が速すぎて目的の疾患細胞に到達する前に大部分が分解されてしまうといった問題点がないかどうかを調べる必要があります。これを可能にするのが、分子イメージングという技術です。代表的な分子イメージングである陽電子放出断層画像法(PET)イメージングにおいては、医薬品候補として開発した分子を安定同位体で標識することで、サルなどの高等動物やヒトでの体内動態を調べることが可能です。この技術は、私たちライフサイエンス技術基盤研究センターの神戸キャンパスにおいて研究技術開発が進められています。
従来の創薬プロセスでは、マウスなどのモデル動物で問題がないことを検証し、それが明らかにされて初めてヒトへの投与にすすみます。しかし、実際にヒトに投与する段階で約9割の医薬候補品が脱落してしまいます。この段階にくるまでにかかった長い時間と膨大な費用が無駄になってしまうのは創薬において非常に大きな問題と考えられています。そこで、ライフサイエンス技術基盤研究センターでは、創薬の初期段階の「構造に基づいた化合物開発」を行う私たち「構造・合成生物学部門」の研究者と、創薬の後期段階の「高等動物での分子イメージング技術開発」を行う神戸の「生命機能動的イメージング部門」の研究者が手を組むことで、高等哺乳動物において有望な医薬候補化合物をできるだけ早期に絞り込む技術革新に取り組んでいます。また、「細胞レベルの遺伝子解析技術」を開発している横浜キャンパスの「機能性ゲノム解析部門」とも連携することで創薬基礎研究を始めとする新しいライフサイエンス技術の開発を進めています。
***
今回のお話では「薬のもと」となる最初の医薬候補化合物をどのように開発するのか?という内容を中心にお話しさせていただきました。現在のところ、病気の治療に使える医薬品の種類や効き目は限られています。しかし、タンパク質の「構造」と「機能」への理解が進むことで、新しい医薬候補品の開発を合理的におこなうことが可能になりつつあります。今回お話ししたように、「試薬」から「医薬」にするまでには非常に多くの研究が必要で、新しい創薬技術も求められています。日本は医薬品を自前で開発できる数少ない国のひとつですが、今後も国際的に競争力を発揮できる創薬技術の開発に私たちも貢献していきたいと考えております。
* 本記事は、2014 年 9 月 6 日に行われた講演をもとに制作しました。
編集・構成 : 鋤納 有実子(広報・サイエンスコミュニケーター)